
Cristallografia
 La cristallografia studia la forma (cristallografia morfologica) e la struttura interna (cristallografia strutturale) dei cristalli.
La cristallografia studia la forma (cristallografia morfologica) e la struttura interna (cristallografia strutturale) dei cristalli.Se si considera la forma esterna si può definire un cristallo come un corpo omogeneo che ha forma di solido geometrico delimitato da facce, spigoli e vertici.
Le dimensioni dei cristalli vanno dall'ordine dei micron (1/1000 di millimetro), come per i minerali argillosi, fino all'ordine del metro come ad esempio per alcuni cristalli di quarzo.
L'insieme delle caratteristiche morfologiche di un cristallo, cioè le facce, gli spigoli ed i vertici, ne determinano il cosiddetto habitus; secondo tali caratteristiche si parla pertanto di cristalli ad habitus prismatico, piramidale, bipiramidale, cubico, tetraedrico, ottaedrico, ecc. Bisogna però avvertire che vi è una netta differenza fra le forme dei solidi geometrici e l'habitus dei cristalli, in quanto, per esempio, un cubo dal punto di vista geometrico è un solido delimitato da 6 facce perfettamente uguali, di forma quadrata e formanti fra loro angoli diedri di 90°, da 12 spigoli di uguale lunghezza e da 8 vertici; un cristallo ad habitus cubico invece può avere le facce e, conseguentemente, gli spigoli un aspetto un po' diverso da quello di un cubo geometrico. Le facce però presenteranno tutte caratteristiche fisiche equivalenti, per cui la determinazione di una proprietà fisica (per esempio la durezza) determinata su una faccia scelta a caso sarà identica a quella determinata sulle altre facce. Un tale cristallo inoltre avrà sempre tutti gli angoli diedri, formati dalle facce adiacenti, di 90°.
Tale proprietà, valida per tutti i cristalli e non solo per quelli cubici, porta alla formulazione della «legge della costanza dell'angolo diedro»: gli angoli diedri fra le facce omologhe di una stessa fase cristallina di uno stesso composto, qualunque sia la provenienza e l'origine (naturale od artificiale) del cristallo, sono sempre uguali a temperatura costante.
In conclusione in cristallografia morfologica avrà importanza solo l'angolo diedro formato da facce contigue e non l'estensione delle facce e degli spigoli. La misura degli angoli diedri di un cristallo (ottenuta mediante l'uso di goniometri di vario tipo) rappresenta pertanto una validissima informazione per il riconoscimento della natura del cristallo stesso.
Simmetria
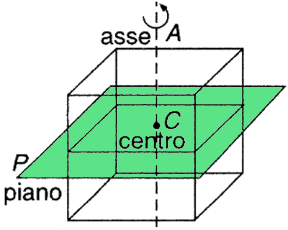 L'ordinazione sistematica che adotta i particolari che caratterizzano la materia cristallina si fonda sul riconoscere in essa gli elementi geometrici di simmetria; questi elementi geometrici sono le rette, i piani e i centri di simmetria. L'esame morfologico, sia macroscopico che microscopico, di un cristallo rivela la presenza di uno o più elementi di simmetria. Così ad esempio da un punto di vista puramente geometrico si può immaginare di generare le facce laterali di un prisma a partire da una di esse mediante rotazioni successive attorno ad un asse che viene preso come asse di simmetria (A); oppure si può immaginare di generare una bipiramide a partire da una singola piramide mediante riflessione rispetto ad un piano analogo ad uno specchio, che viene detto piano di simmetria. D'altra parte il piano P divide la cella in due parti uguali che sono come un oggetto e la sua immagine speculare; in questa posizione esiste un piano di simmetria.
L'ordinazione sistematica che adotta i particolari che caratterizzano la materia cristallina si fonda sul riconoscere in essa gli elementi geometrici di simmetria; questi elementi geometrici sono le rette, i piani e i centri di simmetria. L'esame morfologico, sia macroscopico che microscopico, di un cristallo rivela la presenza di uno o più elementi di simmetria. Così ad esempio da un punto di vista puramente geometrico si può immaginare di generare le facce laterali di un prisma a partire da una di esse mediante rotazioni successive attorno ad un asse che viene preso come asse di simmetria (A); oppure si può immaginare di generare una bipiramide a partire da una singola piramide mediante riflessione rispetto ad un piano analogo ad uno specchio, che viene detto piano di simmetria. D'altra parte il piano P divide la cella in due parti uguali che sono come un oggetto e la sua immagine speculare; in questa posizione esiste un piano di simmetria.In genere in un cristallo sono presenti più elementi di simmetria. Evidentemente nel caso di un cubo siamo in presenza di almeno un asse di simmetria e di un piano. Limitandoci agli elementi di simmetria principali possiamo dire che essi sono rappresentati da : asse, piano, e centro.
Nei cristalli appaiono questi elementi di simmetria che regolano la disposizione degli elementi reali del cristallo stesso (facce, spigoli e vertici) in maniera che da questi ultimi noi possiamo dedurre gli elementi di simmetria posseduti dal cristallo. Gli elementi di simmetria che, soli o combinati fra loro, possono apparire in un cristallo, sono 6: quattro assi di simmetria (binario, ternario, quaternario e senario), il piano di simmetria ed il centro di simmetria.
Forme cristalline
 Il cristallo è formato dall'insieme di facce, spigoli e vertici che si dispongono secondo la simmetria caratteristica della sostanza che lo compone. In accordo con questa simmetria, una faccia, che chiameremo faccia fondamentale, genererà un numero determinato di facce, tutte equivalenti ad essa, dalla cui unione si ottiene una forma cristallina semplice. Per esempio un cubo di cloruro di sodio è una forma semplice. Se diverse forme semplici si uniscono in un medesimo cristallo, si avrà una forma composta (o combinazione); per esempio un cristallo cubico di galena con facce ottaedriche ai vertici.
Il cristallo è formato dall'insieme di facce, spigoli e vertici che si dispongono secondo la simmetria caratteristica della sostanza che lo compone. In accordo con questa simmetria, una faccia, che chiameremo faccia fondamentale, genererà un numero determinato di facce, tutte equivalenti ad essa, dalla cui unione si ottiene una forma cristallina semplice. Per esempio un cubo di cloruro di sodio è una forma semplice. Se diverse forme semplici si uniscono in un medesimo cristallo, si avrà una forma composta (o combinazione); per esempio un cristallo cubico di galena con facce ottaedriche ai vertici.In natura, salvo rare occasioni, i cristalli si presentano in forme composte.
Quando una forma semplice limita una porzione di materia, come nel caso del cubo, si dice che è una forma chiusa mentre se non chiude un volume determinato, come nel caso di un prisma, si dice che è una forma aperta. Ad esempio la Bipiramide trigonale (composta da sei trangoli isosceli) è una forma chiusa, mentre la Piramide trigonale (composto da tre triangoli isosceli) è una forma aperta.
Reticolo cristallino
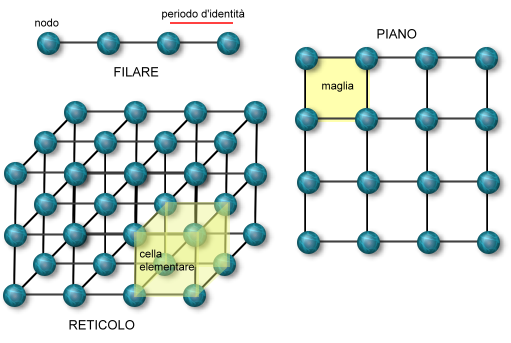 La struttura spaziale ordinata delle particelle costituenti un cristallo può essere descritta come un insieme di punti (corrispondenti alle rispettive posizioni) distribuiti regolarmente nelle tre dimensioni, in altre parole con una rappresentazione del reticolo cristallino.
La struttura spaziale ordinata delle particelle costituenti un cristallo può essere descritta come un insieme di punti (corrispondenti alle rispettive posizioni) distribuiti regolarmente nelle tre dimensioni, in altre parole con una rappresentazione del reticolo cristallino.l reticolo cristallino è formato dalla ripetizione di un'unità strutturale (cella elementare) avente una forma geometrica semplice (per esempio, di cubo o tetraedro) e caratterizzata dalla lunghezza degli spigoli (detti periodi) paralleli a tre assi di riferimento x, y e z (assi cristallografici) e dal valore degli angoli, nello spazio tridimensionale sono possibili soltanto 14 tipi di celle elementari, 7 fondamentali e 7 da questi derivati. Le 7 celle fondamentali individuano 7 sistemi cristallini, ciascuno dei quali comprende le classi (32) che presentano la comunanza di uno o più elementi di simmetria. I sistemi a loro volta si suddividono in tre gruppi (monometrico, dimetrico e trimetrico) che si caratterizzano per i valori dei loro periodi.
Il reticolo cristallino o Reticolo di Bravais è una struttura formata da un elevato numero di atomi legati tra loro attraverso l'interazione elettrostatica generata dal legame ionico; il reticolo, inoltre, può formarsi anche quando tra gli atomi si pone in essere il legame metallico. Nel reticolo cristallino, gli atomi si dispongono in modo tale da massimizzare la loro presenza nello spazio, diminuendo dunque la distanza interatomica, e diminuendo allo stesso tempo l'energia di sistema che prende il nome di energia reticolare.
Quando il reticolo cristallino deriva da strutture legate tra loro attraverso forze ioniche è definito anche come Reticolo di Bravais, in onore al mineralogista francese che, per primo, formulò numerose osservazioni sulla struttura reticolare cristallina. I lavori di Bravais permisero di approfondire le peculiarità chimiche e fisiche del reticolo cristallino. Le strutture ripetute che formano il reticolo cristallino sono definite unità elementari. La disposizione lineare è definita filiare mentre l'intreccio tra più filiari avviene nel nodo. La compattezza delle strutture rende i reticoli cristallini elementi che fanno parte dello stato solido della materia.
Nodi
 Cella elementare
Cella elementare
In essi si trovano particelle materiali della sostanza cristallina. Se queste particelle sono della stessa natura chimica come i metalli , ad esempio tutti atomi uguali e sono ugualmente orientate nello spazio tridimensionale il reticolo cristallino viene detto semplice. Se invece i nodi rappresentano particelle di natura chimica diversa il reticolo cristallino è detto composto. Esempi sono il cloruro di sodio e in genere alogenuri di metalli alcalini che danno un reticolo cubico a facce centrate.
Filari
Sono formati da un insieme di nodi orientati tutti nella stessa direzione e che si trovano a una distanza costante l’uno dall’altro e che è caratteristica delle diverse sostanze cristalline. I filari si identificano con gli spigoli di un cristallo
Piani reticolari
Sono costituiti da un insieme di nodi che sono regolarmente arrangiati lungo una superficie. Le caratteristiche di un piano reticolare sono definite dalle due grandezze lineari a e b e dall’angolo α mediante i quali risulta determinato un parallelogramma elementare regolare. Ogni piano reticolare può essere immaginato come il risultato della ripetizione periodica del parallelogrammo elementare lungo due dimensioni dello spazio. Pertanto un parallelogrammo elementare è il più piccolo piano reticolare che ne conserva tutte le caratteristiche chimiche e fisiche allo stesso modo con il quale le proprietà di un tessuto rispecchiano quelle di ogni singola cellula che lo compongono. Tuttavia, mentre la cellula è una entità fisica ben definita, il parallelogrammo elementare è un’entità immaginaria in quanto è immaginaria ogni linea reticolare. Solo i nodi del reticolo cristallino, infatti, sono entità fisiche reali. I piani reticolari si identificano con la facce esterne dei cristalli.
 Cella elementare
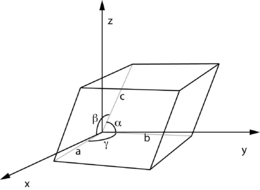
Cella elementare Immaginando di spostare perpendicolarmente a se stesso un piano reticolare, si ottiene un reticolo cristallino che è caratterizzato da tre grandezze lineari: a, b e c, definite dalla distanza di due nodi consecutivi nelle tre dimensioni dello spazio e da tre grandezze angolari α, β e γ le quali sono definite dagli angoli reciproci di queste tre direzioni spaziali. Queste sei grandezze determinano un parallelepipedo elementare la cui ripetizione lungo le tre direzioni primarie, si può immaginare che dia origine all’intero edificio del reticolo cristallino. Assegnando dei valori specifici alla lunghezza degli assi e agli angoli compresi tra essi, possono essere costruite celle elementari di diverso tipo.
Created by Gi Buzz'